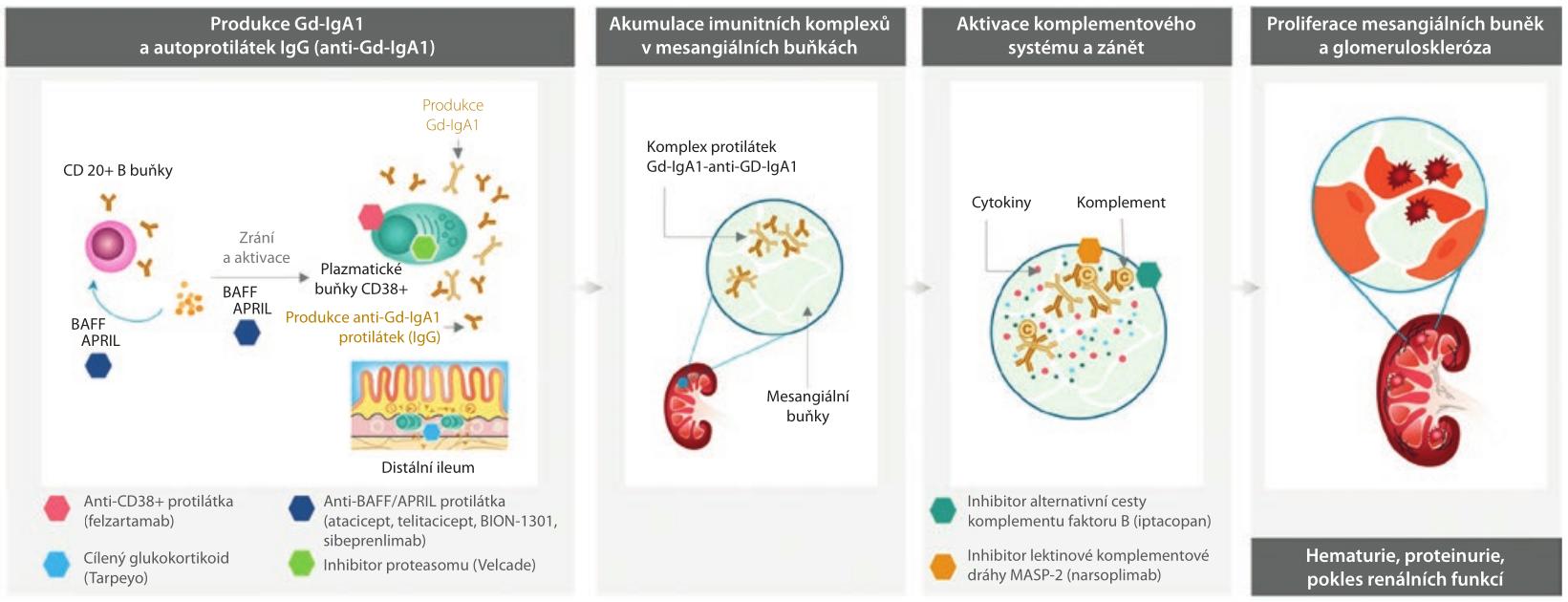
Onemocnění IgA nefropatie (IgAN) je celosvětově nejčastější primární glomerulonefritida. Zásadní úlohu v patogenezi IgAN představují imunokomplexy, které jsou složené z galaktóza‑deficitního imunoglobulinu A1 (Gd‑IgA1) a autoprotilátek proti Gd‑IgA1. Ukládají se v mezangiu glomerulů, kde vyvolávají komplementem zprostředkovaný zánět, který může vyústit ke zhoršení funkce ledvin až k renálnímu selhání. Nová léčba je cílena na imunopatogenezi IgAN, včetně ovlivnění tvorby Gd‑IgA1 imunitními buňkami.
Tento článek se zabývá terapeutickým potenciálem perorálního budesonidu s cíleným uvolňováním pro léčbu IgAN, který byl prokázán v klinické studii fáze III (NefIgArd).
Klíčová slova: IgA nefropatie, TRF budesonid, proteinurie, renální insuficience
ÚVOD
Onemocnění IgA nefropatie (IgAN), celosvětově nejčastější primární glomerulonefritida, až u 40 % pacientů způsobuje selhání ledvin v průběhu dvaceti let od diagnózy. Genetické faktory a vlivy zevního prostředí hrají zásadní úlohu v patogenezi onemocnění spuštěním tvorby galaktóza‑deficitního imunoglobulinu A1 (Gd‑IgA1) a protilátek proti Gd‑IgA1, které vytvářejí imunitní komplexy. Tyto imunitní komplexy se ukládají v mezangiu glomerulů, aktivují komplementový systém, vedou k chronickému zánětu, mezangiální proliferaci, glomeruloskleróze a ztrátě funkce ledvin.
NOVÉ LÉČEBNÉ MOŽNOSTI U IgAN
V současné době jsou k dispozici nové léčebné možnosti, které ovlivňují vlastní imunopatogenezi IgAN, včetně imunitních buněk vytvářejících hlavní spouštěč onemocnění, mezi které patří Gd‑IgA1.
Recentní studie ukázala účinnost a bezpečnost budesonidu s cíleným uvolňováním (TRF‑budesonide, targeted release formulation of budesonide), která ovlivňuje imunitní buňky ve střevě, dlouho žijící plazmatické buňky i paměťové B buňky (schéma 1).
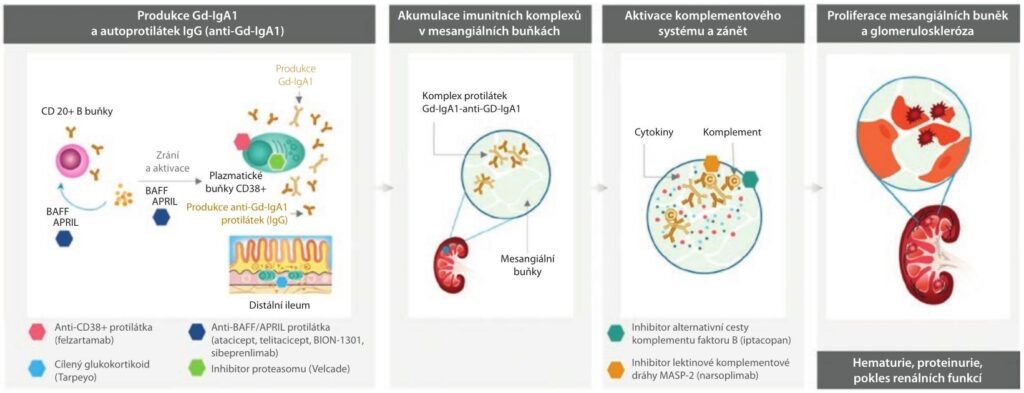
APRIL – ligand vyvolávající proliferaci, proliferation inducing ligand; BAFF – faktor aktivující B‑buňky, B cell activating factor; CD, cluster of differentiation; GD‑IgA1 – imunoglobulin A1 s nedostatkem galaktózy, galactose‑deficient immunoglobulin A1; GFR – glomerulární filtrace, glomerular filtration rate; MASP – serinová proteáza vázající lektin mannan, mannan‑binding lectin serine protease
TRF budesonid působí cíleně na oblast distálního ilea, snižuje aktivitu imunitních buněk včetně buněk tvořících Gd‑IgA1 a tlumí tvorbu imunitních komplexů, čímž omezuje zánět a snižuje riziko poškození ledvin (schéma 2). V klinické studii NEFIGAN (NCT01738035, fáze 2b) zahrnující 150 pacientů s IgAN s přetrvávající proteinurií i přes optimální blokádu renin‑angiotenzinového systému (RAS) TRF budesonid (ve studii označen jako Nefecon) významně snížil proteinurii a stabilizoval parametry funkce ledvin.
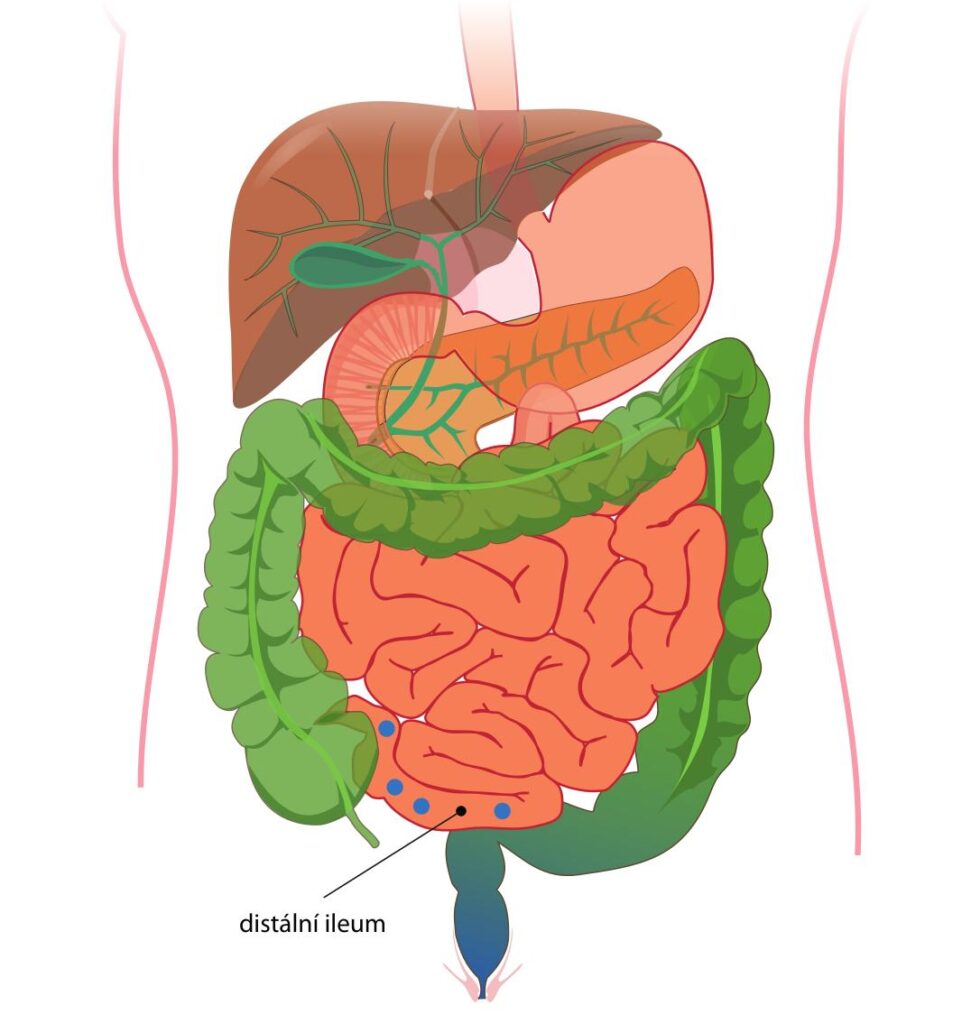
TRF budesonid snižuje aktivitu imunitních buněk produkujících Gd‑IgA1 v oblasti distálního ilea (modré tečky). Do krve je transportováno méně Gd‑IgA1, snižují se i sérové koncentrace protilátek anti‑Gd‑IgA1, stejně jako tvorba a ukládání imunitních komplexů vyvolávajících zánět a poškození ledvin.
TRF budesonid – budesonid s cíleným uvolňováním, targeted release formulation of budesonide
Klinická studie fáze III testovala účinnost a bezpečnost devítiměsíční léčby TRF budesonidem (16 mg) vůči placebu u dospělých pacientů s primární IgAN s rizikem progrese do renálního selhání (NefIgArd, NCT03643965). V části A studie NefIgArd byl 199 pacientům s IgAN podán TRF budesonid nebo placebo po dobu devíti měsíců a sledováni byli další tři měsíce (včetně dvou týdnů se snižováním dávky). Primárním cílem v části A bylo posouzení poměru protein/kreatinin v moči (urine protein creatinine ratio, UPCR) ze sběru moči za 24 hodin po devíti měsících léčby. Sekundárním cílem bylo zhodnocení odhadu glomerulární filtrace (estimated glomerular filtration rate, eGFR) za devět a dvanáct měsíců léčby a UPCR po dvanácti měsících léčby.
Po devíti měsících léčby u všech pacientů s maximálně tolerovanou blokádou RAS a současně léčených TRF budesonidem došlo k významnému snížení UPCR o 27 % ve srovnání s placebem (p = 0,0003), což vedlo k urychlenému schválení FDA (U.S. Food and Drug Administration) (NefIgArd; NCT03643965) (graf 1).

eGFR – odhad glomerulární filtrace, estimated glomerular filtration rate; UPCR – poměr protein/kreatinin v moči, urine protein creatinine ratio, jednotka g/g
Výsledky byly stejné bez ohledu na vstupní hodnoty UPCR, eGFR a proteinurie/24 hodin. U pacientů léčených TRF budesonidem došlo k dalšímu zlepšení UPCR i tři měsíce po ukončení léčby TRF budesonidem (48% pokles UPCR při léčbě TRF budesonidem ve srovnání s placebem, p < 0,0001) (graf 2).
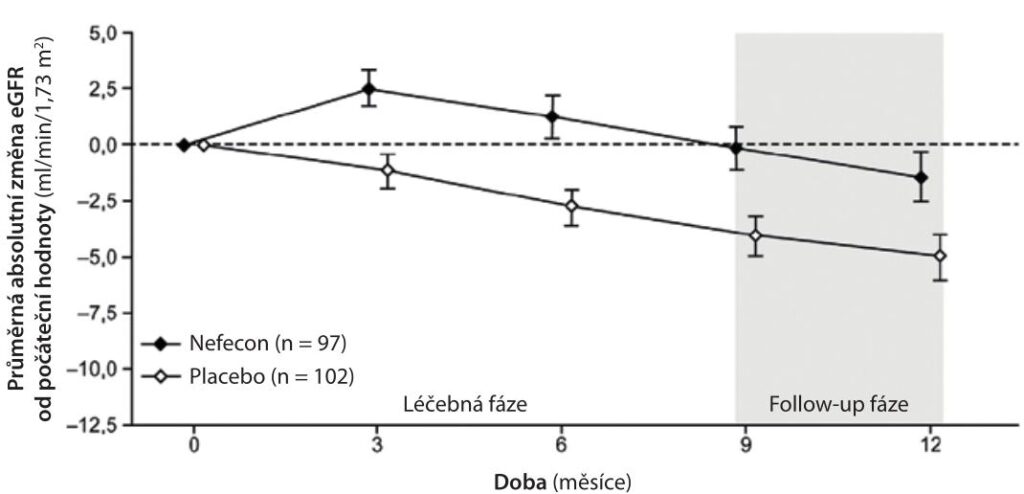
eGFR – odhad glomerulární filtrace, estimated glomerular filtration rate; UPCR – poměr protein/kreatinin v moči, urine protein creatinine ratio, jednotka g/g
Podobně u pacientů významně poklesl poměr UACR o 31 % po devítiměsíční léčbě TRF budesonidem (p = 0,0005) a po dvanácti měsících dokonce o 54 % (p < 0,0001). Po devíti měsících léčby byl pokles eGFR u pacientů léčených TRF budesonidem 0,17 ml/min/1,73 m² ve srovnání s poklesem eGFR 4,04 ml/min/1,73 m² v placebové skupině, což dokazuje statisticky významné zlepšení eGFR o 3,87 ml/min/1,73 m² při léčbě TRF budesonidem (p = 0,0014), které zůstalo podobné i po třech měsících od ukončení léčby (graf 2).
Zlepšení v poklesu eGFR za jeden rok bylo 3,37 ml/min/1,73 m² (p = 0,0111). V podskupině pacientů se vstupní UPCR ≥ 1,5 g/g bylo zlepšení eGFR významnější u pacientů léčených TRF budesonidem ve srovnání se všeobecnou populací (graf 2).
U pacientů s nižší vstupní UPCR (< 1,5 g/g) toto zlepšení v eGFR zaznamenáno nebylo. Nicméně u těchto pacientů se předpokládá účinek léčby TRF budesonidem v delším časovém horizontu, což bylo zhodnoceno v observační části B studie NefIgArd. Do observační části B studie NefIgArd bylo zařazeno 364 pacientů, kteří byli randomizováni v poměru 1 : 1 k léčbě TRF budesonidem (v dávce 16 mg den) a k placebu, byli léčeni po dobu devíti měsíců a sledováni patnáct měsíců. V průběhu léčby a sledování došlo k poklesu eGFR v průměru o 2,47 ml/min/1,73 m² u pacientů léčených TRF budesonidem versus 7,52 ml/min/1,73 m² u pacientů s placebem. V průběhu dvou let sledování činil rozdíl v eGFR 5,05 ml/min/1,73 m² u pacientů léčených TRF budesonidem oproti placebu (p < 0,0001). Po dvou letech, ačkoli pacienti byli bez léčby již patnáct měsíců, byly změny v eGFR – 6,11 ve skupině s TRF budesonidem a – 12,00 ml/min/1,73 m² ve skupině s placebem. Tyto výsledky ukazují přibližně 50% zhoršení eGFR za dvacet čtyři měsíců v placebové skupině oproti pacientům léčených TRF budesonidem prvních devět měsíců (graf 3).

s UPCR > 1,5 g/g
eGFR – odhad glomerulární filtrace, estimated glomerular filtration rate; UPCR – poměr protein/kreatinin v moči, urine protein creatinine ratio, jednotka g/g
Výsledky eGFR byly potvrzeny u všech pacientů bez ohledu na vstupní hodnoty UPCR. TRF budesonid v dávce šestnáct miligramů za den byl velmi dobře tolerován.
Zajímavostí ve výsledcích části A studie NefIgArd byl neočekávaný akutní vzestup eGFR po třech měsících léčby TRF budesonidem, což není dosud detailně vysvětleno. Často jsou totiž takovéto akutní změny v eGFR dávány do souvislosti s hemodynamickým účinkem léčby. Pouze hemodynamický účinek se ale nepředpokládá, očekáván by byl rovněž vzestup proteinurie, což nebylo potvrzeno. Podobně i sarkopenický účinek je nepravděpodobný, protože nebyly zaznamenány změny ve vylučování kreatininu močí v průběhu devítiměsíční léčby TRF budesonidem.
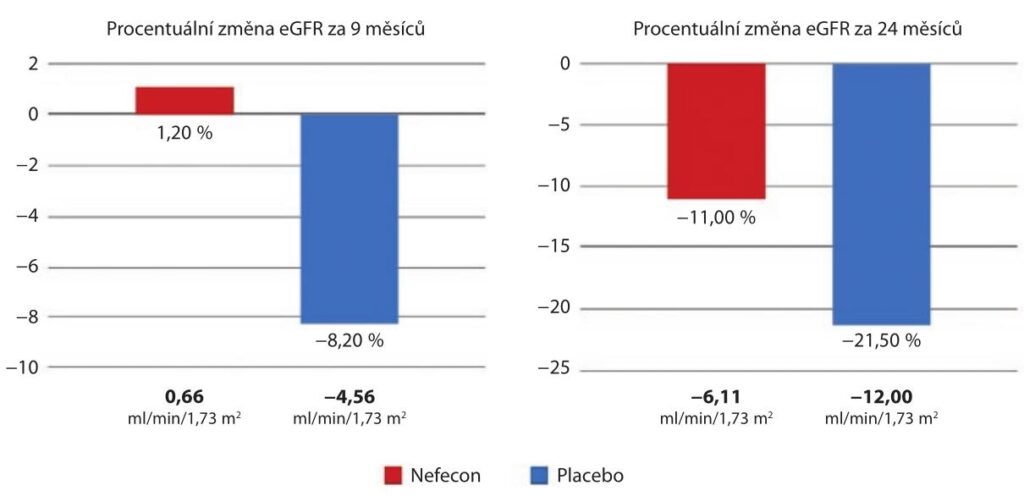
eGFR – odhad glomerulární filtrace, estimated glomerular filtration rate
ZÁVĚR
Klinická studie fáze III NefIgArd prokázala bezpečnou a účinnou devítiměsíční léčbu TRF budesonidem u pacientů s IgAN přidanou k optimální a maximálně tolerované blokádě RAS, která vedla k signifikantnímu zlepšení UPCR, UACR a stabilizaci renálních parametrů (eGFR) ve srovnání s optimální podpůrnou léčbou samotnou.9 Klinická randomizovaná studie NefIgArd je dosud největší komerčně sponzorovaná studie u pacientů s IgAN, která jako první potvrdila účinnost léku, jenž dokáže cíleně ovlivnit patogenezi nejčastější primární glomerulonefritidy. Na základě výsledků studie NefIgArd byl TRF budesonid navržen jako první „disease‑modifying“ lék pro pacienty s IgAN s rizikem selhání ledvin.
DISKUSE
Maximální podpůrná léčba s kombinací blokátorů RAS (inhibitory angiotenzin konvertujícího enzymu [angiotensin‑converting enzyme, ACE] či blokátorů receptorů AT1 pro angiotenzin II [angiotensin receptor blocker, ARB]) a inhibitorů sodíko‑glukózového transportéru 2 [sodium‑glucose cotransporter 2, SGLT2]) a v budoucnu možná i inhibitorů endotelinového systému zůstává základem léčby IgAN. TRF budesonid by měl nahradit systémové kortikoidy u pacientů s vyšší proteinurií a aktivním histologickým nálezem při renální biopsii. Využití systémových kortikoidů bude v budoucnu zřejmě dále omezeno pravděpodobně pouze jen pro pacienty s omezeným přístupem k novým léčebným možnostem. Měli bychom upřednostňovat nové léčebné možnosti s nižším rizikem nežádoucích účinků spojených s imunosupresivní léčbou s kortikoidy.
Všichni pacienti s progresivní IgAN by měli být léčeni rozsáhlou a v současné době stále se rozšiřující podpůrnou léčbou včetně inhibitorů RAS a SGLT2 a možná v blízké budoucnosti i endotelinovými antagonisty. TRF budesonid by měl nahradit systémové kortikoidy s lepší účinností a bezpečností.
Současná léčba nejčastější primární glomerulonefritidy IgAN je stále nedostatečně efektivní. Potenciálně těžká toxicita a nedostatečná účinnost léčby kortikoidy byla nepochybně velmi dobře potvrzena. Nové znalosti a lepší porozumění patogeneze IgAN pomůže zlepšit možnosti léčby IgAN. Rozšiřující se možnosti léčby mohou změnit i definice nových léčebných cílů (např. proteinurie 0,5 g/den) a časnou intervenci u pacientů s méně závažným onemocněním (proteinurie ≥ 0,5 g/den). Cílená léčba by měla být nasazena včas a bez prodlení zejména u pacientů s velmi aktivním onemocněním tak, jak je navrženo recentně vydanými doporučeními Kidney Disease: Improving Global Outcomes (KDGO).
AUTOŘI
Prof. MUDr. Dita Maixnerová, Ph.D.; prof. MUDr. Vladimír Tesař, DrSc., MBA
Klinika nefrologie 1. LF UK a VFN, Praha